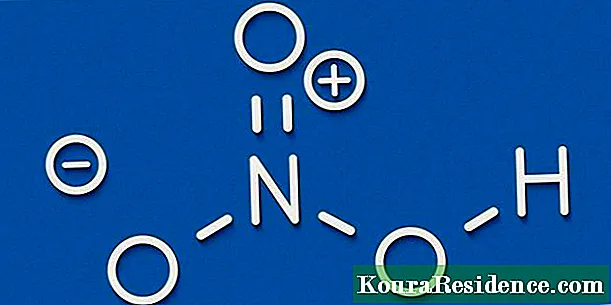
جي ماليڪيول formاھڻ لاءِ ڪيميائي مرڪب, مختلف مادن يا عنصرن جا جوهر لازمي طور تي ھڪ withئي سان مستحڪم طريقي سان ملن، ۽ اھو ٿي سگھي ٿو مختلف طريقن سان ساختي خاصيتن جي لحاظ کان جيڪو ھر ائٽم وٽ آھي ، جيڪو ، جيئن اسان knowاڻون ٿا ، تي مشتمل آھي ھڪڙو مثبت چارج ٿيل نيوڪليس جيڪو اليڪٽرانن جي ڪڪر سان ريو پيو آھي.
اليڪٽران منفي طور تي چارج ٿين ٿا ۽ مرڪز جي ويجهو رهن ٿا becauseاڪاڻ ته برقياتي مقناطيسي قوت ان کي راغب ڪري ٿو. هڪ اليڪٽران جيترو ويجھو آهي نيوڪلئس ڏانهن ، ان کان و theيڪ توانائي گهربل آهي ان کي ڏڻ لاءِ.
پر س allئي عنصر سا theيا ناھن: ڪجھ ۾ ھڪڙو رجحان ھوندو آھي ته ڪڪر جي mostاھرين اليڪٽرانن کي گھٽ ڪري (ڏي (عناصر گھٽ آئنائيزيشن توانائيءَ وارا) ، جڏھن ته tendيا انھن تي قبضو ڪندا آھن (عناصر و electيڪ اليڪٽرانڪ لا withاپي وارا). اهو ٿئي ٿو اڪاڻ ته Lewis octet اصول جي مطابق، استحڪام associatedاهرئين شيل يا مدار ۾ 8 اليڪٽرانن جي موجودگي سان جڙيل آھي ، گھٽ ۾ گھٽ اڪثر ڪيسن ۾.
پوءِ ڪيئن اتي ٿي سگھي ٿو نقصان يا اليڪٽران جو حاصل، برعڪس چارج جي آئنون beھي سگھن ٿيون ، ۽ برعڪس چارج جي آئنن جي وچ ۾ اليڪٽرڪ اسٽيٽسڪ ڪشش انھن کي ملائي ٿي ۽ simpleاھي ٿي سادي ڪيميائي مرڪب ، جن ۾ ھڪڙي عنصر اليڪٽران ڏنو ۽ themئي انھن کي وصول ڪيو. ته جيئن اهو ٿي سگهي ۽ a آئنڪ بانڊ اھو ضروري آھي ته ھڪڙو فرق ھجي يا گھٽ ۾ گھٽ 1.7 جي شامل عنصرن جي وچ ۾ برقي gانivityاپي جو ڊيلٽا.
جي آئنڪ بانڊ عام طور تي ٿئي ٿو ھڪڙي دھاتي مرڪب ۽ غير دھاتي ھڪڙي جي وچ ۾: metalاتو جوهر ھڪڙو يا و electيڪ اليڪٽران ڏئي ٿو ۽ نتيجي طور مثبت چارج ٿيل آئنون (ڪيشن) andاھي ٿو ، ۽ غير دھاتي انھن کي حاصل ڪري ٿو ۽ منفي چارج ٿيل ذرڙو (anion) بڻجي ٿو. الڪلي ۽ الڪلائن earthرتيءَ جا areاتو اهي عنصر آهن جيڪي اڪثر ڪري ڪيشن formاهيندا آهن ، ۽ هالوجن ۽ آڪسيجن عام طور تي آئنون آهن.
عام طور تي، مرکبات جيڪي ionic bonds مان ھيل آھن آهن solids ڪمري جي حرارت تي ۽ گھڻي پگھلڻ واري جاءِ تي ، پاڻيءَ ۾ گھلڻ وارو. حل ۾ اهي تمام گهڻا آهن س ofو برقي هلائيندڙجيئن اهي مضبوط اليڪٽرولائٽس آهن. هڪ آئنڪ ٽائيڊ جي لٽيس انرجي اھو آھي جيڪو نشان ل theائي ٿو پرڪشش قوت ان ائڊس جي وچ ۾.
اھو توھان جي خدمت ڪري سگھي ٿو:
- Covalent Bonds جا مثال
- ميگنيشيم آڪسائيڊ (MGO)
- کاپر سلفيٽ (CuSO4)
- پوٽاشيم آئوڊائڊ (KI)
- زنڪ هائيڊروڪسائيڊ (Zn (OH) 2)
- سوڊيم ڪلورائيڊ (NaCl)
- سلور نائٽريٽ (AgNO3)
- ليتيم فلورائيڊ (ليف)
- ميگنيشيم کلورائڊ (MgCl2)
- پوٽاشيم هائيڊروڪسائيڊ (ڪوه)
- ڪلسيم نائٽريٽ (Ca (NO3) 2)
- ڪلسيم فاسفٽ (Ca3 (PO4) 2)
- پوٽاشيم ڊيڪرو ميٽ (K2Cr2O7)
- ڊسڊيم فاسفٽ (Na2HPO4)
- آئرن سلفائيڊ (Fe2S3)
- پوٽاشيم برومائڊ (KBr)
- ڪلسيم ڪاربونيٽ (CaCO3)
- سوڊيم هائيڪو ڪلورائيٽ (NaClO)
- پوٽاشيم سلفيٽ (K2SO4)
- مينگانيز کلورائيڊ (MnCl2)